Bài 7: Sự gấp cuộn và sự biến đổi protein
Amino acid
Chuỗi polypeptide: trình tự các aa đặc trưng và chính xác, từ đầu N - amino → đầu C - carboxyl, (trái → phải)
Sự gấp cuộn đúng phụ thuộc chủ yếu vào sự sắp xếp của các aa phân cực và không phân cực:
- Các aa kỵ nước: kết tụ bên trong (lực kỵ nước) → tạo lk H với các aa tương tự/khung sườn của chuỗi.
- Các aa ưa nước: nằm ở mặt ngoài để dễ tạo lk H với các pt phân cực khác.
Còn lệ thuộc vào các lk yếu: lk H, lực hút tĩnh điện, lực van der Waals, lực kị nước
Bậc 1, 2 của protein
Bậc 1: 1 chuỗi trình tự các aa gắn kết nhau bởi liên kết peptide.
Bậc 2: tự cuộn (do lk H giữa các nhóm -C=O- và -NH-)
Xoắn
Protein α-keratin (lông, tóc, móng, sừng).
Ống trụ gồ ghề.
Tạo thành giữa 4 lk peptid
LK H giữa -CO- của lk peptid này với gốc -NH- của lk peptid khác
Các mạch bên R lộ ra ngoài
Thường có ở các protein màng (protein vận chuyển/thụ thể - protein ABC)
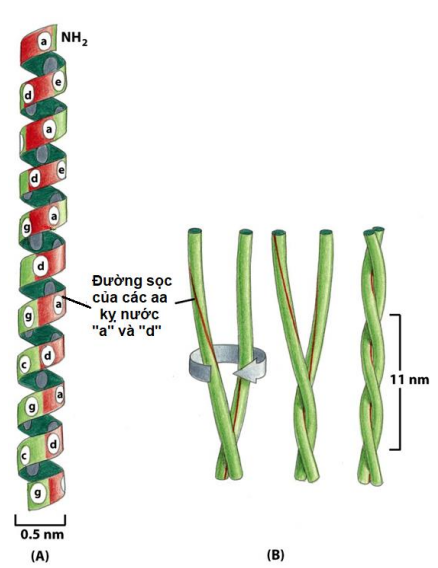
Cấu trúc xoắn cuộn: dài, hình gậy, vững chắc. (cấu trúc khung → sợi kéo dài)
Xoắn
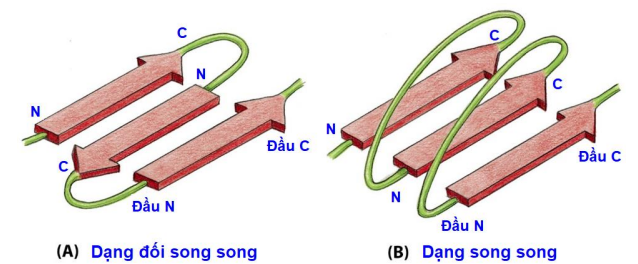
3-10 aa
Thùng tròn (8-22 phiến/thùng) → Có các lỗ lọc H2O/pt nhỏ ưa nước đi qua lớp lipid kép
Hiện diện ở màng ngoài ty thể, lục lạp và vi khuẩn.
Các chuỗi bên kỵ nước xếp dọc bên ngoài thùng β → tương tác lớp lipid kép, bên trong được lót bằng những aa ưa nước
Bậc 3, 4 của protein
- Bậc 3: Các xoắn α, phiến β, đoạn ngoặt β và vòng β tự cuộn → cấu trúc bậc 3 (lập thể)
- Bậc 4: nhiều chuỗi polypeptide bậc 3 có thể giống (khác) nhau kết hợp lại.
Nếu 2 protein l.kết dạng “đối diện nhau” tại vị trí gắn kết → Phức hợp protein đối xứng có 2 tiểu phần (1 dimer)
Domain ($\approx 40 - 350aa) gấp thành từng cụm bậc 3 → chức năng riêng biệt
Chaperone
Là các protein + ATP hỗ trợ các chuỗi polypeptide (Giấu các gốc kỵ nước vào lõi protein ngay khi dịch mã)
- Gấp cuộn đúng
- Phát hiện, dừng, chỉnh sửa các protein gấp cuộn sai, gấp cuộn 1 phần ➔ Hơn 95% protein gấp cuộn đúng.
Hỗ trợ lắp ráp các hạt nucleosome (Histon + DNA).
Chaperone của Eukaryote có trong bào tương và ty thể, lục lạp và LNC hạt,... Một số chaperone là protein sốc nhiệt (Heat-shock protein) → chịu nhiệt
2 loại: Chaperone (Hsp70) và Chaperonin (Hsp60)
- Hsp70: hoạt động sớm, gắn vào khoảng 7 aa kỵ nước trước khi chuỗi polypeptide rời khỏi Ri.
- Hsp60: là loại có thùng chứa, hoạt động sau khi chuỗi polypeptide mới được tổng hợp (chưa gấp cuộn) hoặc protein gấp cuộn sai → Cô lập trong mt ưa H2O
Sự hình thành liên kết Disulfide
Enzyme Disulfide isomerase nối 2 nhóm –SH giữa 2 cysteine trong cùng/khác chuỗi
Dịch nội bào có nồng độ chất khử cao → Lk S-S bị khử thành -SH → Chỉ tạo ra khi tb chuẩn bị xuất bào
Protein tiết/vùng kỵ nước protein xuyên màng
VD: Lyzozyme (nước mắt - 4 lk S-S), Insulin (3 lk S-S)
Một số hình dạng 3D của protein
(Protein hình cầu, Protein dạng sợi xoắn ốc dài và Protein dạng sợi dài)
Hình cầu
Hầu hết các chuỗi polypeptide gấp cuộn thành protein
Dạng sợi xoắn ốc dài
Nhiều protein tương đồng + có một điểm gắn phù hợp với một vùng → Chuỗi sợi xoắn ốc dài
- Các actin hình cầu (Globular actin) → Sợi actin (Fillament actin) → Vi sợi
Dạng sợi dài
Sợi α-keratin: mỗi cuộn xoắn được che ở hai đầu bởi các domain hình cầu có các vị trí gắn → Dễ ráp lại với nhau ➔ Sợi trung gian (dày như dây thừng)
Sợi colagen:
- Chất nền ngoại bào
- 3 chuỗi xoắn
- Nhiều phân tử collagen dính sát nhau → Các mảng chồng chéo dài → Bền và cứng → Sức căng cho mô liên kết
Sợi elastin:
- Dịch ngoại bào
- Polypeptide lộn xộn, lỏng lẻo, đàn hồi
- Ngược lại với Elastin
- Da, nhu mô phổi và động mạch
Chức năng của protein
Tất cả protein gắn kết được với phân tử khác
Cấu trúc bề mặt protein quyết định tính chất HH
Giữa các phần kế nhau của chuỗi polypep → ngăn cản H2O cạnh tranh với ligand
- Các aa phân cực gần nhau → Dễ đẩy lẫn nhau → Tăng ái lực với các ion điện trái dấu
- aa này tạo lk H với aa khác → Tác động đến aa ở chỗ khác → Hình thành hoặc phá vỡ các l.kết CHT
P.ứng hóa học đặc trưng phụ thuộc
- aa nào lộ ra ngoài
- Tương tác với các p.tử khác
Protein gắn protein
- Mặt này lõm - mặt kia nhô ra
- Xoắn
- Bề mặt gồ ghề của 2 protein khớp nhau → Chắc chắn
Nguy cơ gây bệnh
- Các protein kết tụ ko bị phân hủy → Tích tụ, thoát ra từ tb chết, tích lũy trong mô → Phá hủy mô
- Tạo ra các sợi fibril xếp chồng lên nhau → Cấu trúc các sợi β đan chéo → Các mảng xơ vữa amyloid.
Một số bệnh liên quan protein gấp cuộn sai: Bệnh khí phế thủng, Alzheimer, Prion, Hungtinton
Prion
- Prion là protein vô hại (PrP; PrPc)
- Gen PRNP (20p13)
Người nhiễm prion gây bệnh (PrP*; PrPsc) là do:
- Ăn thịt: bò điên, người chết; dịch y tế,.... có PrP*
- Các prion trong cơ thể bị ĐBG hay do di truyền.
Prion gây bệnh (PrP*; PrPsc) và có tính lây truyền (như VK, virút) → Va, đụng các prion bình thường khác → Gấp cuộn sai → tạo ra và tích luỹ nhiều prion bệnh → Thoái hoá tb TK → Teo não → Chết từ từ